Коллеги - педагогический журнал Казахстана
Наша библиотека
| Главная » Файлы » В помощь учителю » Химия |
Реакции ионного обмена и условия их протекания. Молекулярные, полные и сокращенные ионные уравнения
| [ Скачать с сервера (605.8 Kb) ] | 2015-01-16, 8:45 PM |
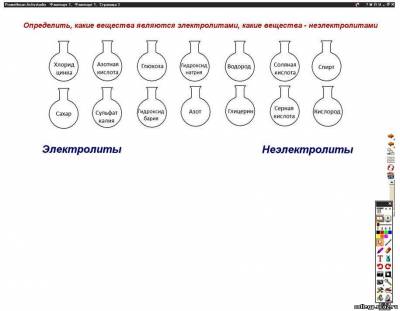
| Тема. Реакции ионного обмена и условия их протекания. Молекулярные, полные и сокращенные ионные уравнения реакций. Цель. Сформировать понятие реакции ионного обмена, рассмотреть условия протекания реакций ионного обмена до конца. Задачи. Образовательные: изучить на конкретных примерах реакции ионного обмена и условия их протекания до конца. Развивающие: развивать у учащихся умения составлять молекулярные, полные и сокращенные ионные уравнения реакций и объяснять их сущность в свете теории электролитической диссоциации. Воспитательные: воспитывать интерес к предмету, добросовестное отношение к учебе и культуру общения учащихся в группах. Тип урока. Урок изучения нового учебного материала. Вид урока. Урок – сообщающая беседа. Оборудование. Нитрат бария, серная кислота, карбонат натрия, гидроксид натрия, пробирки, компьютер, интерактивная доска. План урока 1. Оргмомент. 2. Этап побуждения. 3. Этап реализации. 4. Этап рефлексии. 5. Подведение итогов урока. 6. Домашнее задание. Ход урока Оргмомент. Целевая установка. Изучить на конкретных примерах реакции ионного обмена и рассмотреть условия их протекания до конца. Этап побуждения. Химическая разминка. Проверка домашнего задания. В качестве химической разминки учащимся предлагаются задания на интерактивной доске. Флипчарт. Страница 1 Задание № 1. Определить, какие вещества являются электролитами, какие вещества – неэлектролитами. Что такое электролиты? Что такое неэлектролиты? Флипчарт. Страница 2 Задание № 2. Закончить определение. Повторяется учебный материал из физики о катоде и аноде. Какие электролиты относятся к сильным электролитам, к электролитам средней силы и к слабым электролитам? С помощью слайдов на интерактивной доске проводится проверка письменного домашнего задания – упражнения № 1 на странице 20. Этап реализации. Изучение нового материала. Продолжаем изучать теорию электролитической диссоциации. Разработал эту теорию в 1887 г. шведский ученый Сванте Аррениус. Свое дальнейшее развитие теория электролитической диссоциации получила в трудах русских ученых Дмитрия Ивановича Менделеева и Ивана Алексеевича Каблукова. Нужно отметить и казахстанского ученого Михаила Ильича Усановича, который тоже внес определенный вклад в развитие этой теории. Известный советский химик, доктор химических наук, профессор, академик АН КазССР, он в 1939 г. предложил новую теорию кислотно-основного взаимодействия, которая вошла в мировую научную литературу под названием «Обобщенная теория кислот и оснований». Учащиеся работают в группах по 4 человека, выполняют лабораторный опыт № 1. Каждая группа работает по своей индивидуальной карточке по дифференцированным заданиям. Карточка № 1 Проведите химическую реакцию между нитратом бария и серной кислотой. Назовите признак химической реакции. Составьте молекулярное уравнение химической реакции. Карточка № 2 Проведите химическую реакцию между карбонатом натрия и серной кислотой. Назовите признак химической реакции. Составьте молекулярное уравнение химической реакции. Карточка № 3 Проведите химическую реакцию между гидроксидом натрия и серной кислотой. Назовите признак химической реакции. Составьте молекулярное уравнение химической реакции. Обращается внимание ребят на то, что у всех групп в задании присутствует серная кислота – один из важнейших продуктов химической промышленности, который производится в г. Усть-Каменогорске. После проведенного опыта ребята составляют только молекулярные уравнения химических реакций и самостоятельно приходят к выводу, когда реакции ионного обмена протекают до конца. На интерактивной доске демонстрируются слайды, на которых представлены молекулярные, а также полные и сокращенные ионные уравнения реакций для всех трех случаев. Слайд № 7. Слайд № 8. Слайд № 9. На основании опытов формулируется вывод. Реакции ионного обмена протекают до конца в трех случаях: а) если выпадает осадок; б) если выделяется газ; в) если образуется слабый электролит (например, вода). Проводится самостоятельная работа с учебником. Учащиеся выписывают примеры молекулярных, полных и сокращенных ионных уравнений реакций (§ 6, стр. 20–22). Этап рефлексии. Для закрепления нового материала учащимся предлагаются задания по трем уровням сложности. Задание выполняется каждым учеником индивидуально. Разноуровневые задания демонстрируются на интерактивной доске. Подведение итогов урока. Выставление оценок. Обсуждение писем родителям. Домашнее задание. § 6. Упражнение № 2, страница 23. Уровень С. ∆ Упражнение № 4, стр. 23–24. | |
| Просмотров: 1509 | Загрузок: 49 | Комментарии: 3 | | |
Воскресенье, 2026-02-01, 1:01 PM
Приветствую Вас Гость
Приветствую Вас Гость
Форма входа |
|---|
Категории раздела | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Социальные закладк |
|---|
Поиск |
|---|
Друзья сайта |
|---|
Теги |
|---|
Статистика |
|---|